ملف كامل العـلاج الكيمـاوي و تعـداد خلايا الـدم
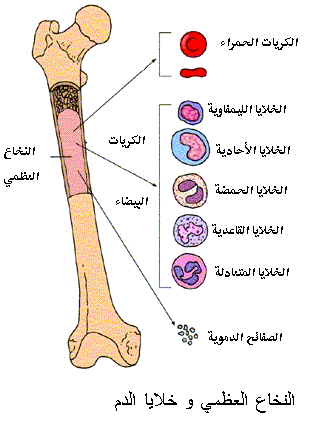
إحباط النخـاع العـظمي يتم إنتاج كريات الدم المختلفة بالنخاع العظمي، و هو النسيج الإسفنجي اللين و المسمى بالنخاع الأحمر، و المتواجد داخل جزء العظام المعروف بالعظم الإسفنجي، و يوجد غالبا في العظام المسطحة، مثل عظم الجمجمة، و الأكتاف، و الضلوع، و عظام الحوض، و مفاصل الذراعين و الرجلين، و تتمثل وظيفته الأساسية في إنتاج خلايا الدم، و يتكون النخاع العظمي من الخلايا المولدة لمكونات الدم ( hematopoietic cells )، و خلايا دهنية، و أنسجة تساعد على نمو خلايا الدم، و تُعرف الخلايا المولدة للدم بخلايا الأرومة أو خلايا المنشأ ( Stem cells)، و هي تقوم بالتكاثر بشكل متواصل، لتنتج خلايا منشأ جديدة، يبقى جزء منها على حاله كخلايا إنشائية مولدة تواصل التكاثر، بينما يتوقف الجزء الآخر عن التكاثر و يمر بسلسلة من التحولات المتعاقبة و الانقسامات التراكمية، لينضج متحولا إلى خلايا الدم المختلفة ( كريات الـدم البيضـاء و الحمراء و الصفائح الدموية )، و التي تواصل مراحل نموها و نضجها داخل النخاع قبل الانتقال إلى الدورة الدموية لتأدية وظائفها.
النخاع العظمي و خلايا الدم و من ناحية أخرى، تكمن فاعلية العقاقير الكيماوية في مقدرتها على التداخل مع مراحل التطور و النمو السريع للخلايا السرطانية، و التي هي بطبيعتها خلايا نشطة و سريعة النمو و التكاثر، مما يعيق وظائفها الحيوية و يؤدي إلى تدميرها، و بالمقابل تؤثر العقاقير على بعض أنواع الخلايا الطبيعية التي تنمو بسرعة و تتكاثر بغزارة و دائمة الاستبدال، مما يؤدي بدوره إلى نشوء المضاعفات الجانبية المصاحبة للعلاج الكيماوي، و التي يُعد من أهمها و أكثرها شيوعا، ما يٌعرف اصطلاحاً بإحباط النخاع العظمي( bone marrow suppression )، و الذي ينجم عن التأثير المدمر للعقاقير الكيماوية على أنسجة و خلايا النخاع العظمي، مما يؤدي إلى قصوره عن إنتاج الكمّ اللازم من كريات الدم المختلفة، و انخفاض معدلاتها بالدورة الدموية، الأمر الذي يؤدي بدوره إلى نشوء عدة مخاطر تنجم عن ضعف فاعلية كريات الدم لنقص تعدادها، إضافة إلى ضرورة تعديل الجرعات العلاجية أو إيقافها لحين تعافي النخاع، مما يقلل من فاعلية المعالجة ضد الخلايا الورمية.
تجدر الإشارة إلى أن أنواع كريات الدم تختص بوظائف محددة، فكريات الدم الحمراء ( Red blood cells ) تحتوي على الهيموجلوبين ( Hemoglobin ) أو خضاب الدم الذي يحمل الأكسجين من الرئتين إلى كافة خلايا الجسم، و يعود محملا بثاني أكسيد الكربون، و يؤدي نقصها إلى نشوء فقر الدم، و تُعد كريات الدم البيضاء ( White blood cells ) العنصر الأساسي في المنظومة المناعية بالجسم، و تختص بمهاجمة الأجسام الغريبة مثل البكتيريا أو الفيروسات و تكافح العدوى، و يتسبب نقصها في ضعف الجهاز المناعي و يؤدي إلى سهولة التقاط أنواع العدوى المختلفة دون المقدرة على مقاومتها، بينما تلعب الصفائح الدموية ( platelets ) الدور الرئيسي في عمليات تجلط الدم، مما يرتق الجروح أو القطوع أو التمزقات بأي موضع بالجسم و يوقف النزف، و يؤدي نقصها إلى فقد المقدرة على تجلط الدم و بالتالي سهولة النزف لأدنى سبب و بأي موضع بما في ذلك الأعضاء الحيوية الداخلية.
كما أن لخلايا الدم فترات حياة متفاوتة و محددة بالدورة الدموية تبلى بعدها و تنتهي، و يتم استبدالها بإنتاج جديد من النخاع العظمي بشكل مستمر و متواصل، حيث يبلغ متوسط عمر الكريات البيضاء حوالي ست ساعات، بينما يبلغ متوسط فترة حياة الصفائح الدموية حوالي عشرة أيام، أما كريات الدم الحمراء فتعيش في المتوسط حوالي 120 يوما. و يجدر بالذكر أن تعداد كريات الدم بالدورة الدموية لا ينخفض بشكل فوري عقب البدء بتلقي جرعات العلاج الكيماوي، إذ أن العقاقير لا تؤثر بشكل مباشر على خلايا الدم الموجودة بالدورة الدموية، بينما تؤثر بالمقابل على أنسجة النخاع المنتجة لخلايا الـدم، و على الخلايا القاصرة التي ما تزال تمر بأطوار الولادة و النمو السريع و تتسبب في تدميرها، الأمر الذي يؤدي في المحصلة إلى إحباط النخاع و إعاقته عن إنتاج كريات دم جديدة.و بانتهاء فترة حياة خلايا الدم الموجودة بالدورة الدموية، و عجز النخاع المُحبط عن إنتاج البدائل، يبدأ تعداد خلايا الدم في الانخفاض إلى مستويات حرجة، و خلال فترات زمنية متفـاوتة، ( تبعا لنـوع العقار الكيمـاوي المستخدم و جرعته بطبيعة الحال )، و تستمر وضعية الإحباط و هبوط معدلات تعداد خلايا الدم لحين تعافى النخاع و عودته إلى وتيرة الإنتاج العادية عقب مرور فترات زمنية متفاوتة.
و من هنا يسمى اقل مستوى يبلغه تعداد خلايا الدم عند إحباط النخاع بمستوى الندرة ( nadir )، و يصل تعداد كل نوع من خلايا الدم إلى هذا المستوى خلال فترات متفاوتة عقب تلقي المعالجات، حيث قد يبلغ تعداد الكريات البيضاء و الصفائح الدموية مستوى الندرة خلال فترات تتراوح بين 3 إلى 7 أيام و أحيانا خلال 14 يوما، بينما قد يبلغه تعداد الكريات الحمراء خلال عدة أسابيع، إذ أنها تعيش لفترة أطول. و من جهة أخرى يتم بشكل دائم إجراء التحليلات الدورية المختلفة للدم عند تلقي العلاج الكيماوي، و منها تعداد خلايا الدم الكُلي (complete blood count CBC ) و أحيانا بشكل يومي، لمراقبة تأثيرات العقاقير على النخاع و التقلبات في معدلات خلايا الدم، ( كما قد يتم استخلاص عينات من النخاع لتفحّص الخلايا المنتجة لكريات الدم )، و بطبيعة الحال يعتبر المريض في الوضع الحرج عند بلوغ التعدادات لمستوى الندرة، و تتخذ الإجراءات الطبية اللازمة و الإحتياطات الوقائية، بما في ذلك تعديل الجرعات العلاجية بتخفيضها أو تأجيلها أو إيقافها لحين عودة المعدلات إلى المستويات الملائمة، و الجدير بالذكر أن الدراسات السريرية للعديد من الأورام قد أثبتت أن معدلات الشفاء تنخفض بين المرضى، حين يضطر الأطباء إلى تخفيض الجرعات العلاجية أو تأجيلها لفترات متطاولة، بسبب من مضاعفات إحباط النخاع، بينما ترتفع حين يتمكن المرضى من تلقي الجرعات كاملة، و حسب الجدولة الزمنية المحددة للخطط العلاجية. و نستعرض في الفقرات التالية نبذة عن مضاعفات إحباط النخاع العظمي الناتج عن استخدام العقاقير الكيماوية، و تأثيرات النقص في معدلات كريات الدم، و التي تشمل نشوء فقر الدم ( Anemia ) لدى المريض، و نشوء حالة عوز كريات الدم البيضاء ( leukopenia )، و حالة عوز الصفائح الدموية ( Thrombocytopenia ).
عـوز كريات الـدم البيضاء يتراوح التعداد الطبيعي لكريات الدم البيضاء بين 4.000 إلى 10.000 خلية في الملليمتر المكعب من الدم، و هي تنقسم إلى قسمين رئيسيين :
الخلايا المُـحببة ( Granulocytes )
التي تحتوي على حبيبات في سائلها الخلوي ( السيتوبلازما ) المحيط بنواة الخلية، و هي تتفرع إلى ثلاثة أنواع، الخلايا المتعادلة أو العَدلات ( neutrophils )، و الخلايا الحَمِضة ( eosinophils )، و الخلايا القاعدية ( basophils ).
الخلايا غير المُـحببة ( Agranulocytes )
و التي لا تحتوي على حبيبات بالسيتوبلازما، و هي تنقسم إلى ثلاثة أنواع: الخلايا الليمفاوية ( lymphocytes )، و الخلايا الأحادية ( monocytes )، و الخلايا الملتهمة أو اللاهمة ( macrophages ).
و تطرأ حالة عوز كريات الدم البيضاء ( leukopenia ) عند انخفاض معدلاتها بالدم أثناء دورات العلاج الكيماوي، و عجز النخاع العظمي المُحبط عن إنتاج البدائل بالكمّ اللازم، حيث قد ينخفض المستوى إلى 500 خلية على مم3 أو اقل، إلا أن المريض يعتبر في حالة عوز فعلية بمجرد انخفاض التعداد تحت مستوى 1.000 خلية على مم3، و إذ تلعب الكريات البيضاء الدور الرئيسي في مكافحة العدوى و القضاء على الكائنات الغريبة المهاجمة للجسم، فانخفاض تعدادها يضعف جهاز المناعة، و يعرض المريض لمختلف أنواع العدوى التي يلتقطها بسهولة، مما يستلزم المراقبة الدقيقة لتقلبات التعداد تحسبا لذلك.
و يتم التركيز بشكل دائم عند تلقي جرعات العلاج الكيمـاوي على معدلات الخـلايا المُحببة و خصوصا الخلايا المتعادلة، لدورها الرئيسي في مكافحة العـدوى المختلفة، إذ يُعد الانخفاض الحاد في معدلات الخلايا المتعادلة من أهم المؤشرات على ارتفاع مخاطر تعرض مرضى السرطـان للعدوى، و تحسبا لذلك يتم حساب تعداد الخلايا المتعادلة الكـلّي ( absolute neutrophil count ANC ) عند إجراء تعداد الدم الكلي بُغية تحديد مدى مقدرة الجسم على مكافحة العدوى، فمعدل تعدادها الطبيعي يتراوح بين 2500 إلى 6000 خلية على المليمتر المكعب، و عند هبوط معدلها الكـلّي إلى مستوي 1000 خلية أو اقل يعتبر المريض في حالة عوز الخلايا المتعادلة ( Neutropenia )، و أكثر عرضة للتأثر بأية عـدوى، بينما عند المستوى 500 أو اقل يعتبر في حـالة عـوز حـادة، و تتخذ كافة الاحتياطات الوقائية، بما في ذلك البدء بتناول المضادات الحيوية كإجراء احترازي، و قد يُعزل المريض كلياً للمحافظة على سلامته، إضافة إلى تعديل الجرعات العلاجية أو تأجيلها لحين عودة التعداد إلى المستوى الملائم، ( يُرجى الانتقال لصفحة تعدادات الدم لمزيد من التفاصيل حول معدلات التعداد ).
و بهذا الصدد تجدر الإشارة إلى أن حالة عوز الخلايا المتعادلة قد تنجم عن أسباب أخرى غير العقاقير الكيماوية، مثل تناول بعض الأدوية، أو كنتيجة لتأثيرات الأورام نفسها، لذلك تقتضي معالجة حالة العوز ضرورة تحديد السبب الكامن وراءها. معالجة عـوز الكريات البيضاء
يُعد إنتاج ما يُعرف بمحفزات نماء مولدات الدم ( hematopoietic growth factors )، و تسمى أيضا بالعوامل المحفزة للإعمار (Colony-stimulating factors CSFs )، من أهم التطورات الحديثة في معالجة الأورام، و هي من المكونات الطبيعية التي ينتجها الجسم و تم تحضيرها في المعامل على نطاق واسع، و تعمل كمحفزات لخلايا المنشأ ( stem cells ) بالنخاع العظمي، بحيث تحثها و تدفعها لزيادة معدلات التكاثر و التحول لإنتاج خلايا الدم المختلفة، و يتم استخدامها بالتوازي مع العلاج الكيماوي للمساعدة عند إحباط النخاع العظمي و انخفاض معدلات كريات الدم، بُغية التقليل من الفترات الزمنية لنقصها، و التمكن من تلقي العلاج الكيماوي دون تأخير دوراته لفترات طويلة، و بجرعاته المحددة بالخطط العلاجية، إضافة إلى التمكن من تناول الجرعات العلاجية العالية التي تستلزمها بعض الحالات.
و ثمة نوعان من هذه المحفزات يستخدمان عند عوز الخلايا البيضاء :
محفزات إعمار الخلايا المُحببة ( Granulocyte colony-stimulating factor G-CSF )، و اسمها المتداول تجاريا فيلقراستيم (Filgrastim ) أو نيوبوجين ( Neupogen )، و هي تقوم بتحفيز إنتاج الخلايا المُحببة.
محفزات إعمار الخلايا المحببة و الملتهمة ( Granulocyte-macrophage colony-stimulating factor GM-CSF ) و اسمها المتداول سارقراموستيم ( sargramostim )، و ليوكاين ( Leukine )، و هي تقوم بالحثّ على إنتاج كلّ من الخلايا المُحببة و الخلايا اللاهمة.
و هذه المحفزات مجهزة على هيئة حقن، يتم تلقيها وريديا أو تحقن تحت الجلد، و قد يتم حقنها قبل المباشرة بجرعات العلاج الكيماوي، أو أثناءها أو عقب انتهائها مباشرة، و ذلك حسب المخطط العلاجي المقرر، و إن كان المعتاد حقنها بعد يوم أو نحوه من انتهاء الجرعات العلاجية.
و يجدر بالذكر أنه إضافة إلى استخدام هذين النوعين بغرض الرفع من معدلات إنتاج الكريات البيضاء، مما يقلل من مخاطر التعرض للعدوى عند حالات العوز، يستخدمان أيضا للرفع من معدل إنتاج خلايا المنشأ عند التحضير لعمليات زرع نقى النخاع العظمي.
( يُرجى الانتقال لصفحة العلاج المناعي لمزيد من التفاصيل حول محفزات النماء ).
عـوز كريات الـدم البيضاء و العـدوى تُعد العدوى من اشد المخاطر التي قد يتعرض لها الطفل المريض بالسرطان و خصوصا عند تلقي العلاجات و نشوء حالة عوز الخلايا المتعادلة، و من الطبيعي أن انخفاض معدلات كريات الدم البيضاء أو وجود حالة العوز لا يعني بالضرورة أن الطفل سيتعرض للعدوى، غير انه يكون بوضع أكثر حرجا و خطورة و من السهل جدا التقاط أية عدوى، حتى البسيطة منها و التي ما كانت لتؤثر على الجسم في الأحوال العادية حيث يعمل الجهاز المناعي بكفاءة، الأمر الذي يستلزم أن يبقى الأهـل يقظين على الدوام و متنبهين لأيٍ من علامات العدوى، و اتخاذ الإجراءات الملائمة حال ظهور أعراضها، و إبلاغ طبيب الأورام المختص بالسرعة القصوى، إذ أن بعض أنواع العدوى تُعد خطرة بشكل جديّ و مهددة لحياة الطفل و خلال فترات زمنية قصيرة.أنواع العـدوى من المعتاد أن تظهر العـدوى بمواضع متعددة من الجسم، و هي تشمل عند مرضى السرطـان :الجلد و البشرة، و الفـم و الحنجرة، المريء، التجويف البطني و الكبد و المستقيم، الرئتين، المثانة و الكليتين، و الجهاز العصبي المركزي ( الدماغ و الحبل الشوكي )، إضافة إلى مواضع الحقن الوريدي أو أدوات القسطرة.و يتم تصنيف العدوى حسب نوع الجراثيم المسببة لها، أي البكتيريا و الفيروسات و الطفيليات وحيدة الخلية، و الفطريات، و تنجم في اغلب الأحوال ( عند وجود عوز بالخلايا المتعادلة ) عن البكتيريا و الفيروسات التي تعيش على سطح الجلد أو في الجهاز الهضمي، و إن كانت أحيانا تنجم عن الأنواع الموجودة بالبيئة المحيطة، و بطبيعة الحال فهذه الميكروبات لا تسبب أية عدوى في الظروف العادية حيث يتمكن الجهاز المناعي من مكافحتها، إلا أنها عند ضعفه نتيجة تلقي علاجات الأورام يمكن أن تنشط و تتسبب في عدوى جدية.
و تُعد العدوى البكتيرية من أكثر أنواع العـدوى عند مرضى السرطان، و تنتج في اغلب الأحوال عن أنواع البكتيريا التالية على وجه الخصوص :بكتيريا الزائفة الزنجارية ( Pseudomonas aeruginosa )، الكلبسلة الرئوية ( Klebsiella pneumoniae )، الاشريكية العصوية القولونية ( Escherichia coli (E coli) )، المطثيات المغزلية المستعصية ( Clostridium difficile )، المكورات المعوية ( Enterococcus ) و العقدية ( Streptococcus )، و الرئوية ( Pneumococcus ) و المكورات العنقودية ( البرتقالية و المداهمة للبشرة ) (Staphylococcus aureus, epidermidis ).
بينما تنجم الأنواع الشائعة من العدوى الفيروسية عند انخفاض معدلات الخلايا المتعادلة عن الفيروسات التالية :الفيروسات المسببة للقوباء ( herpes )، مثل فيروس العقبول البسيط ( herpes simplex virus )، و فيروسات جدري المـاء أو الحُماق ( chickenpox )، و التي يمكنها أيضا الانتقال إلى الأعضاء الحيـوية و التسبب بعـدوى خطرة مثل الالتهابات الرئـوية و الدماغية، و الفيروس المسبب لعلّة التضخم الخلوي ( Cytomegalovirus ) و الذي يمكنه أيضا التسبب بعدوى بالعيون و الجهاز الهضمي و الالتهابات الرئوية، إضافة إلى الفيروسات المسببة للحصبة بأنواعها. أما الطفيليات و الكائنات الأولية ( protozoa ) و التي من المعتاد أن تسبب العدوى لدى المرضى فتشمل :
البوغيات المستخفية (Cryptosporidium )، المتكيسات الرئوية ( Pneumocystis )، و المقوسات (Toxoplasma ).
و فيما يتعلق بالفطريات التي تعيش بتوازن داخل الجسم في الأحوال الطبيعية فيمكن أن تتسبب بدورها في نشوء أنواع من العدوى سواء عند ضعف الجهاز المناعي و نشوء العوز بالخلايا المتعادلة، أو عند الاستمرار بتناول الستيرويدات لفترات طويلة.
و تشمل الفطريات المسببة للعدوى عند مرضى السرطان : الرشاشيات ( Aspergillus ) و الفطور المكوّنة للعفـن، و المبيضـات ( Candida )، إضافة إلى المكـورات المستخفـية (Cryptococcus )، و النوسجيات ( Histoplasma ).أعراض العـدوى من علامات و أعراض وجود العدوى لدى المريض و التي ينبغيالتحسب لها و التنبه لظهورها، و من ثم إخطار الطبيب المعالج دون تأخير :الحُمّى و ارتفاع درجة الحرارة إلى أكثر من 38 درجة مئوية.الإرتجاف أو شدة التعرّق، أو الشعور بالبرودة أو السخونة.سعال أو سعال مخاطي، قصر النفس أو تنفس مؤلم و صعب.حساسية أو انتفاخ، أو التهابات بالفم أو الحنجرة، أو بقع بيضاء بالفم و اللثة، أو تغيّر لون اللثة.
احتقان أو سيلان الأنف، أو صعوبة البلع.
حرقة أو ألم عند التبول أو التبرز، أو وجود رائحة بالبول.
المغص أو الشعور بأوجاع بالتجويف البطني، أو وجود إسهال.
احمرار أو ألم أو انتفاخ بأي موضع بالجلد أو وجود موضع بالجسم تبدو حرارته مرتفعة عن غيره عند لمسه.
احمرار أو ألم أو انتفاخ و حكة عند موضع الحقن الوريدي، أو موضع أنابيب الحقن.
احمرار أو انتفاخ أو سخونة بموضع جرح أو تقطيبات جراحية، أو تقرح بأي جرح غير ملتئم.
الشعور بالتشوش الذهني أو الصداع و الدوار أو الإرهاق.التحاليل المخبرية لتشخيص العـدوى عند الاشتباه بوجود عدوى يتم إجراء العديد من التحاليل المخبرية، لتحديد نوعها و لتقصي الحالة، و منها :
إجراء تعداد الدم الكامل، و تقصي تعداد الخلايا المتعادلة.
إجراء مزرعة للدم على عينتين يتم سحبهما من موضعين مختلفين، لتقصي وجود الميكروب المسبب للعدوى بالدم.
إجراء مزرعة للبول.
إجراء أشعات للصدر للتحقق من مدى وجود التهابات رئوية.
إجراء مزرعة لسوائل الجسم من المواضع المشتبهة بالتعرض للعدوى، مثل الحنجرة عند وجود التهابات.
و من ناحية أخرى قد يتم إجراء تحاليل خاصة إضافية عند الاشتباه بوجود ميكروب مسبب للعدوى و من الصعب تحديده.الإحتياطات الوقائية لتجنب العـدوى من التدابير الاحترازية التي يمكن اتخاذها لتقليل فرص التقاط العدوى و تجنبها :تكرار غسل الأيدي على مدار الساعة، للطفل المريض و لجميع أفراد العائلة، و خصوصا قبل تحضير الطعام و قبل الأكل، و عند دخول المنزل و عقب استعمال الحمام، و ينبغي استخدام صوابين معقمة و مطهرة مضادة للبكتيريا و الجراثيم، و الغسل بالماء الدافيء مع دلك اليدين جيدا، و من الضروري متابعة الطفل المريض بشكل دائم في هذه العملية.تكرار استخدام مطهرات الفم غير الكحولية.
عدم نزع البشرة الجافة أو قطعها، و استعمال المعاجين المرطبة بدلاً من ذلك.
عدم استعمال مزيلات الرائحة التي تغلق مسام الجلد مما يسهل العدوى.
استعمال حفاضات الأطفال المعقمة، و المحافظة على نظافة و جفاف مواضعها لمنع الحساسية.
إبعاد الطفل عن المرضى، و من يكون مصاباً بأحد الأمراض المعدية سهلة الانتشار مثل الأنفلونزا.
إبعاد الطفل عن الأطفال حديثي التطعيم باللقاحات الحية.
إبعاد الطفل عن التجمعات البشرية و الأسواق و المواصلات العامة.
ارتداء الأحذية لمنع حدوث أي جروح أو قطوع أو خدوش بالأقدام.
منع الطفل من الاقتراب من الآلات الحادة أو أماكن الطهي، لمنع الجروح أو الحروق.
إبعاد الطفل عن التواجد تحت أشعة الشمس المباشرة و تجنب حروقات الشمس.
عدم حلاقة شعر الطفل بالشفرات العادية و استخدام آلة الحلاقة الكهربائية لتجنب الجروح، و تجنب حلاقة الوجه لدى المراهقين.
عدم إعطاء الطفل أية تطعيمات أو لقاحات دون موافقة الطبيب المعالج، و خصوصا اللقاحات الحية التي تمنع بتاتاً.
منع الطفل من ممارسة الألعاب الجماعية أو ركوب الدراجات أو ما يمكن أن يؤدي إلى حدوث الجروح.
إبعاد الطفل عن الحيوانات المنزلية، و عدم تغيير ديكورات المنزل أو طلائه أثناء دورة العلاج الكيماوي.الإحتياطات الإضافية عند عـوز الخلايا البيضاء و بلوغ مستوى الندرةمراقبة حرارة الطفل دوريا كل أربع ساعات و إبلاغ الطبيب المعالج في الحال عند تجاوز حرارة الجسم لدرجة 38 مئوية.تجنب الأطعمة النيئة بما في ذلك :سلطة الفواكه و الخضراوات غير المطهية أو سلطات السمك النيئ.الجبن الطبيعي غير المبستر و البيض النيئ.الفواكه الطازجة أو المجمدة أو المجففة.البهارات و التوابل.القهوة و العصائر و مثيلاتها التي تحضر باردة.عدم إعطاء التحاميل أو قياس الحرارة شرجيا.عدم إجراء أية عمليات على الأسنان، و عند الضرورة القصوى يلزم إبلاغ الطبيب المعالج، لإعطاء موافقته لدى طبيب الأسنان الذي ينبغي إعلامه بحالة الطفل الراهنة و العلاجات المتلقاة.استعمال الملينات الموصوفة من قبل طبيب الأورام عند وجود إمساك، و تجنب الهصر و محاولة التبرز بقوة.
يُفضل فصل الطفل عن الأطفال المرضى الآخرين عند المراجعات بالمستشفى، و استعمال مدخـل جـانبي و الانتظار بغرفة أو مكان معزول، بدلاً من الاختلاط بالأطفال المرضى في غرفة الانتظار الرئيسية، و يُفضل حجز مواعيد المراجعات في الصباح الباكر قبل فترة الازدحام، حيث لم يتواجد الكثير من المرضى بغرفة المعاينة.من المناسب منع العناق و التقبيل للطفل عند زيارات الغرباء، و التي يلزم تقليصها إلى ابعد حد ممكن.بطبيعة الحال ينبغي المحافظة عـلى المستويات الجيدة من التغـذية الملائمة و الكافية و الغنيّـة بالبروتينات و السعرات الحرارية.معـالجة العـدوى
مع كل الاحتياطات المذكورة آنفا لا يزال احتمال التعـرض للعـدوى كبيرا، و عند الاشتباه بوجودها و ظهـور عـلاماتها و أعراضها ينبغي على الأهل عرض الطفل على طبيب الأورام المعالج دون تأخير، أو التوجه لأقرب إسعاف و إخطار الأطباء عن حالة الطفل و تشخيصه و العلاجات المتلقاة، ليتم البدء بالعلاجات المناسبة إلى حين الاتصال بطبيب الأورام، و ننوه إلى ضرورة عدم إعطاء الطفل أية أدوية لتخفيض حرارته و خصوصا الأسبرين دون التأكد من موافقة الطبيب المعالج، ( و يُرجى الانتقال لصفحة الحُمى لمزيد من التفاصيل ).
و تعتبر المضـادات الحيوية خط العلاج الأساسي للعـدوى، و يتم البدء بتلقيها دون تأخير عقب الفحـص البدني و إجراء التحاليل المخبرية، و دون انتظار لنتائج هذه التحاليل التي تتطلب وقتا طويلا، و قد يتم لاحقا تغيير نوع المضـادات المستخدمة تبعا لهذه النتائج، و ثمة هـامش واسع من المضادات الحيـوية الممكن استخدامها، و يتم اختيار النـوع المناسب تبعا لموضع العـدوى و نـوعها و الميكروبات المسببة و الحالة الصحية العامة للمريض، و بطبيعة الحال تُعد بعض أنواع العدوى بسيطة، بينما بعضها الآخر يشكل خطرا جديا و من الصعب معالجته و قد يتطلب الأمر استخدام أنواع عديدة من المضادات.
و من المعتاد تناول المضادات بالحقن الوريدي و قد يتم أحيانا تناولها عن طريق الفم، و بطبيعة الحال تتفاوت تأثيراتها الجانبية، مما يستدعي ضرورة مراقبة المريض تحسبا لهذه التأثيرات عند استخدام أنواع قوية من المضادات، و تعتمد العناية الطبية على مدى استجابة الجسم للعدوى، فقد يحتاج بعض المرضى إلى العناية المركزة و ضرورة الإقامة بالمصحة، بينما قد لا يستدعي الحال ذلك عند البعض الآخر، و من الطبيعي أن يتم إجراء الفحوصات الدورية و التحاليل المختلفة أثناء تلقي معالجات العدوى للتأكد من القضاء عليها، بتفحص موضع العدوى لتقصي مدى تأثره، و تقصي تعداد كريات الدم البيضاء و الخلايا المتعادلة بانتظار عودتها إلى المستويات الملائمة للمساعدة على مكافحة العدوى.فقـر الـدم ( Anemia ) يحتوي الدم عادة على كمية تتراوح بين 4.0 إلى 6.0 مليون كريّة حمراء في الملليمتر المكعب، و يعتبر الهيموجلوبين أو اليحمور الجزء الأهم ضمن مكونات الكريات الحمراء، حيث يختص بنقل الأكسجين و ثاني أكسيد الكربون عبر مجمل أنسجة و خلايا الجسم، و تعطي معدلاته صورة واضحة عن مقدرة الدم على نقل الأكسجين، حيث ينخفض تركيزه عن معدله الطبيعي، و الذي يتراوح بين 11.5 إلى 13.5 جرام / ديسيلتر لدى الأطفال، عند انخفاض تعداد الكريات الحمراء، و يهبط بالتالي مستوى الأكسجين بالجسم، و يعتبر الطفل في حالة فقر الدم عند انخفاض تعداد اليحمور إلى اقل من 10 جرام / ديسيلتر، و بطبيعة الحال تزداد حدة فقر الدم كلما انخفض التعداد، ( يُرجى الانتقال لصفحة تعدادات الدم لمزيد من التفاصيل حول تعداد الكريات الحمراء ).
و تشير الإحصاءات الطبية إلى أن أكثر من 60 % من مرضى السرطان يتعرضون لفقر الدم عقب العلاج الكيماوي، و بطبيعة الحال قد ينجم فقر الدم عن أسباب أخرى، فقد ينتج عن تأثيرات الورم نفسه أو عن العلاج الإشعاعي أو نتيجة فقد الدم أثناء العمليات الجراحية، و من الضروري تحديد السبب الكامن وراء فقر الدم للتمكن من تحقيق المعالجة الناجعة.
أعراض فقـر الـدم من الأعراض الشائعة لفقر الدم و التي تنجم عن نقص إمدادات الأكسجين للأنسجة و الأعضاء الحيوية :ضعف و تعب و إرهاق لأدنى جهد و الشعور المتواصل بالإعياء.صداع، دوار و دوخة مختلفة الشدة.شحوب البشرة، و ابيضاض الشفتين و مهد الأظافر.قصر النفس أو صعوبة التنفس، و وجيب القلب و سرعة خفقانه.شعور بثقل أعلي الأقدام.دويّ و طنين في الأذنين.الشعور بالبرد.و ينبغي إخطار طبيب الأورام المعالج عند ظهور أي من الأعراض الآتية على وجه الخصوص :دوار شديد أو إغماء، أو الشعور بضعف و إرهاق شديدين.قصر النفس و صعوبة التنفس، أو سرعة خفقان القلب و الشعور بألم في أعلى الصدر.و غني عن القول أن فقر الدم إضافة إلى تأثيراته السلبية على المريض و إعاقته لتقدم المعالجات حسب المخططات العلاجية، قد يؤدي أيضا إلى مضاعفات ثانوية مثل زيادة الجهد على عضلات القلب، الأمر الذي يستلزم ضرورة التنبه لأعراضه حال ظهورها. معالجة فقـر الـدم يعتبر فقر الدم الناتج عن العلاج الكيماوي عارضا مؤقتا يزول عقب انتهاء المعالجات، تعود بعدها معدلات الكريات الحمراء إلى مستوياتها العادية، و تتم معالجته بطبيعة الحال بزيادة معدلات اليحمور بالدم، و ذلك إما بإجراء عمليات نقل الدم الكامل أو نقل الخلايا الحمراء المصفاة لتعويض النقص، أو باستخدام محفزات النماء، و عادة لا يتم اللجوء إلى عمليات نقل الدم إلا عند ظهور أعراض فقر الدم بشكل حاد، نظرا لمخاطرها المحتملة و المتعددة، مثل تفاعلات الحساسية للدم المنقول أو مخاطر العدوى البكتيرية أو الفيروسية، و من الطبيعي أن يتم إجراء التحاليل المخبرية المختلفة للتحقق من صحة الدم المنقول.أما محفزات النماء المستخدمة عند فقر الدم فتعرف بمعززات تولد الكريات الحمراء ( Erythropoietin )، و أسماء العقاقير المتداولة منها ايبويتين الفا ( epoetin alfa ) و بروكريت ( Procrit )، و هي تحفز النخاع العظمي على زيادة إنتاج الكريات الحمراء، مما يقلل من الحاجة إلى إجراء عمليات نقلها، كما تساعد في التخفيف من أعراض فقر الدم، و يتم تناولها على هيئة حقن تحت الجلد و عادة لثلاثة أيام أسبوعيا، و لحين عودة التعدادات إلى المستويات الملائمة.و من التوصيات المفيدة عند نشوء فقر الدم :تحديد نشاطات الطفل و تجنب النشاطات المرهقة.زيادة ساعات النوم و معدلات الراحة بما في ذلك النوم أثناء النهار.المحافظة على التغذية الملائمة و الكافية، و الغنية بالسعرات الحرارية و البروتين و الحديد، و خصوصا تناول الخضار الخضراء، و اللحوم الحمراء و الكبد، و من الأطعمة المناسبة أيضا، السمك و المأكولات البحرية و الدجـاج، و البقوليات مثل الفاصوليا، و الفول السوداني.زيادة معدلات تروية الجسم والإكثار من تناول السوائل المختلفة.تجنب القهوة و مركبات الكافيين و الأكلات الدسمة الثقيلة أثناء الليل.
معالجة عـوز الصفـائح الدمـوية
كما سبقت الإشارة، تُعد حالة عوز الصفائح الناتجة عن العلاج الكيماوي عارضا مؤقتا يزول عقب انتهاء المعالجات، تعود بعدها معدلات الصفائح إلى مستوياتها العادية، و تتم المعالجة بطبيعة الحال إما بإجراء عمليات نقل الدم الكامل الذي يحتوي ضمنه على الصفائح، أو نقل الصفائح المصفاة لتعويض النقص، أو باستخدام محفزات النماء.
و من المعتاد إجراء عمليات النقل بمجرد هبوط المعدلات إلى المستوى الحرج أو كإجراء احتياطي عند بلوغ التعداد مستوى 20.000 ، و ثمة تعقيدات قد تصاحب هذه العمليات بطبيعة الحال، مثل تفاعلات الحساسية المعتدلة و الشديدة، أو مخاطر العدوى البكتيرية أو الفيروسية، كما قد يتطور رد فعل مناعي تجاه الصفائح المنقولة عقب إجراء عمليات نقل متعددة، مما يؤدي إلى تدمير الكميات المنقولة، و رغم هذه التعقيدات يتم نقل الصفائح كمعالجة شائعة للعوز الناتج عن العلاج الكيماوي.
أما أنـواع محفزات النمـاء المستخدمة لدى عـوز الصفائح الدموية فهي العقاقير المتداولة باسم اوبـريلفكن ( Oprelvkin ) و نيوميغا ( Neumega )، و التي تحث النخاع العظمي على زيادة معدلات إنتاج الصفائح الدموية، و بالتالي تقليل الحاجة إلى عمليات نقلها للمرضى، و تحقن عادة تحت الجلد بجرعات يومية.




















 Bookmarks
Bookmarks You are Unregistered, please
You are Unregistered, please  Forum Home
Forum Home Contact Staff
Contact Staff Payment
Payment
 08-01-2015 12:13
08-01-2015 12:13




